딥러닝을 사용한 CT 영상 촬영의 방사선 노출 위험 절감
작성자: Dr. Ryohei Nakayama, Ritsumeikan University
컴퓨터 단층 촬영(CT 또는 CAT) 스캔은 장기, 뼈 및 혈관의 3D 이미지를 생성하기 때문에 단순한 X-선 촬영보다 현저하게 높은 진단적 가치를 가지고 있습니다. 이처럼 진단적 측면에서는 가치를 더해 주지만 잠재적으로 유해한 방사선에 노출될 위험이 증가합니다. CT 스캔으로 생성되는 3D 이미지는 컴퓨터 소프트웨어로 겹쳐진 2차원 X-선 이미지가 모여서 만들어집니다. 결과적으로 흉부를 단일 CT 스캔할 경우 평균 방사선 유효 선량은 7mSv(밀리시버트)이며, 이는 흉부 X-선 촬영 시 노출되는 0.02mSv보다 350배 높은 수치입니다. [1] 방사선 노출은 발암 위험과 상관관계가 있으며 가이드라인에서는 어린이 대상 CT 스캔의 경우 방사선량을 1.5mSv로 제한하고 있습니다.
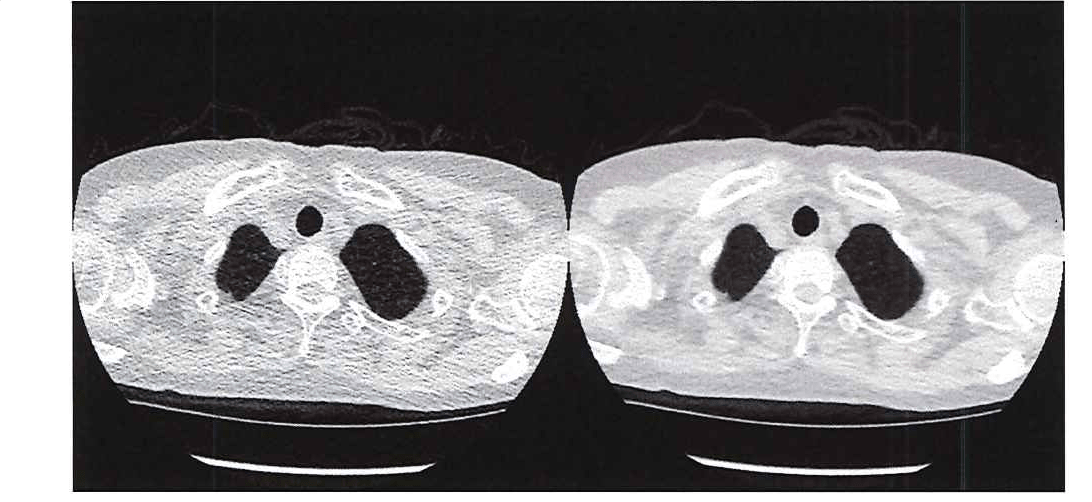
의학자들은 의사들이 필요로 하는 이미지 선명도를 제공하는 동시에 방사선 노출을 제한할 방법을 찾고 있습니다. 한 가지 유망한 방법은 초저선량 CT를 사용하는 것으로, 흉부 이미지의 평균 유효 선량이 약 0.13mSv입니다. [1] 초저선량 CT 스캔의 주요 단점은 해상도가 상대적으로 낮고 노이즈가 크다는 것입니다. 이로 인해 의사가 장기, 지방, 간질 조직을 확인하기 어려울 수 있습니다(그림 1).
저는 회귀 분석 컨볼루션 신경망(CNN)을 MATLAB® 소프트웨어 시스템으로 개발했습니다. 이 시스템은 초저선량 CT 스캔을 입력으로 사용하지만 일반 선량 CT 스캔과 유사한 이미지 품질을 생성합니다. 따라서 환자의 방사선 노출을 최대 95%까지 줄이면서 일반 선량 CT와 유사한 수준의 진단 정보를 의사에게 제공합니다.
초해상도 및 CNN
저선량 CT 이미지 품질의 개선 방법을 연구하기 시작했을 때, 저는 초해상도 기술을 적용하였습니다. 이때 MATLAB을 사용하여 CT 이미지를 작은 로컬 영역으로 분할하고 저선량 영역과 일반 선량 영역을 짝으로 구성하여 이미지 사전을 구축했습니다. 이 시스템은 새로운 저선량 이미지를 분석할 때 이미지 사전에서 작은 저선량 영역을 찾아내고 사용자에게 맞는 일반 선량 패치를 제시합니다.
이 기술의 유효성은 충분한 비교 데이터를 보유한 대규모의 사전을 갖출 수 있는지에 따라 좌우됩니다. 하지만 사전의 크기가 커지게 되면 시스템의 리소스 수요가 증가합니다. 여기서 중요하게 생각해야 할 부분이 바로 작은 이미지를 찾는 데 필요한 검색 시간입니다. CNN은 학습하는 데 시간이 소요되지만, 새로운 이미지가 입력되었을 때 제가 개발한 초해상도 방식보다 훨씬 빠르게 결과를 산출합니다. 예를 들어, 학습된 CNN은 환자 1명을 대상으로 약 20분 이내에 결과를 산출하는 반면, 초해상도를 사용하여 유사한 결과를 얻는 데에는 약 2시간이 걸렸습니다.
초해상도의 결점을 해결하기 위해 CNN 회귀 분석에 대한 연구를 시작했지만, 사실 초해상도 기술이 명백히 좋은 결과를 보여 주는 경우도 있습니다. 예를 들어, 진단하려는 이미지의 패턴이 사전에 있는 이미지의 패턴과 매우 유사할 때 초해상도 방식은 매우 정확한 결과를 산출합니다. 이에 따라 저는 CNN 회귀 분석과 초해상도를 결합하는 하이브리드 시스템을 구축할 계획입니다.
이미지 확보 및 CNN 구축
초저선량 흉부 CT 스캔의 선명도를 개선하기 위해 2개의 CNN을 사용하는 방식을 적용하였는데, 하나는 CT 이미지의 폐 영역을 담당하고 나머지 하나는 폐 이외의 영역을 담당하도록 했습니다.(그림 2). CNN을 학습하는 데 사용했던 이미지 데이터 세트는 미에 대학교(Mie University)의 연구원들이 제공해 주었습니다. 이 이미지 데이터 세트는 12개 이미지 쌍으로 구성되어 있으며, 각 쌍은 동일한 조직에 대한 일반 선량 스캔과 초저선량 스캔을 포함하고 있습니다. (촬영을 두 번 한다는 것은 환자가 방사선에 추가로 노출된다는 의미이므로 비교적 적은 수의 피험자를 대상으로 연구를 수행해야 했습니다.) 각 이미지는 512 x 512픽셀이었고 스캔마다 250개 이미지(조각)를 포함하고 있습니다.
CNN의 초기 구조는 초해상도에 대한 저의 이전 연구 결과를 기초로 했습니다. 이 연구에서 7 x 7 크기의 로컬 영역이 가장 우수한 성능을 나타낸다는 것을 알아냈고, 이 크기로 딥러닝 모델을 구축하기 시작했습니다. 그 다음에는 5 x 5와 128 x 128 사이의 로컬 영역 크기를 실험하여 산출된 각 결과의 선명도를 확인한 후, 폐 영역에는 32 x 32로, 폐 이외의 영역에는 64 x 64 크기로 결정했습니다. 또한 MATLAB을 함께 이용하여 약 128개의 각기 다른 CNN 변형을 평가했고 다양한 컨볼루션 레이어뿐만 아니라 각기 다른 입력 크기와 필터를 시도했습니다.
CNN 학습 및 검증
교차 검증을 사용하여 환자 11명의 이미지로 모델을 학습하고 나머지 환자 1명의 이미지를 이용해 모델을 테스트했습니다. 또한 서로 다른 학습 세트 및 테스트 이미지를 이용해 이러한 단계를 12회 반복했습니다. 이 프로세스를 가속화하기 위해 Parallel Computing Toolbox™를 사용하여 다중 NVIDIA® GeForce 시리즈 GPU로 병렬적으로 학습했습니다. 그리고 학습 프로세스를 모니터링하기 위해 Deep Learning Toolbox™의 모니터링 시각화 옵션을 사용하여 정확도와 손실을 그래프로 작성했습니다(그림 3).
각 초저선량 테스트 이미지의 결과는 이미지 품질 메트릭을 측정하기 위한 RMS(제곱평균제곱근) 레벨 및 SSIM(구조적 유사성 지수)을 사용하여 상응하는 일반 선량 이미지와 비교해 평가되었습니다.
다음 단계
실제 임상 환경에서 저의 CNN 기반 시스템을 사용하는 계획이 마련되어 있습니다. 또한 의료 이미지를 편리하게 보관하고 액세스할 수 있는 PAC(의료영상 저장 및 전송) 서버에 이 시스템을 구축하기 위한 방법을 연구하고 있습니다. MATLAB으로 의료 이미징 소프트웨어를 개발하면서 얻을 수 있는 여러 이점 중 하나는 손쉽게 기본 알고리즘에 대한 인터페이스를 만든 후 전체 패키지를 의사에게 배포할 수 있는 환경입니다. 이는 제가 만든 다른 MATLAB 기반 시스템에서이미 완료한 프로세스입니다.
리츠메이칸 대학교는 캠퍼스 차원에서 MATLAB 및 Simulink에 대한 엑세스를 제공하는 전세계 1,000개 이상의 대학 중 한 곳입니다. Campus-Wide License로 연구원, 교수진 및 학생은 강의실, 실험실 등 어느 곳에서나 최신 버전의 제품을 사용할 수 있습니다.
2018년 기고
참조
-
"What are the Radiation Risks from CT?" U.S. Food and Drug Administration. https://www.fda.gov/radiation-emitting-products/medical-x-ray-imaging/what-are-radiation-risks-ct
-
Wang R, et al. "Ultralow-radiation-dose chest CT: accuracy for lung densitometry and emphysema detection." American Journal of Roentgenology (2015). 204: 743-749. 10.2214/AJR.14.13101. https://pubmed.ncbi.nlm.nih.gov/25794063/